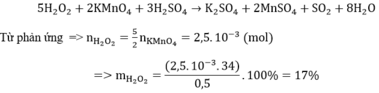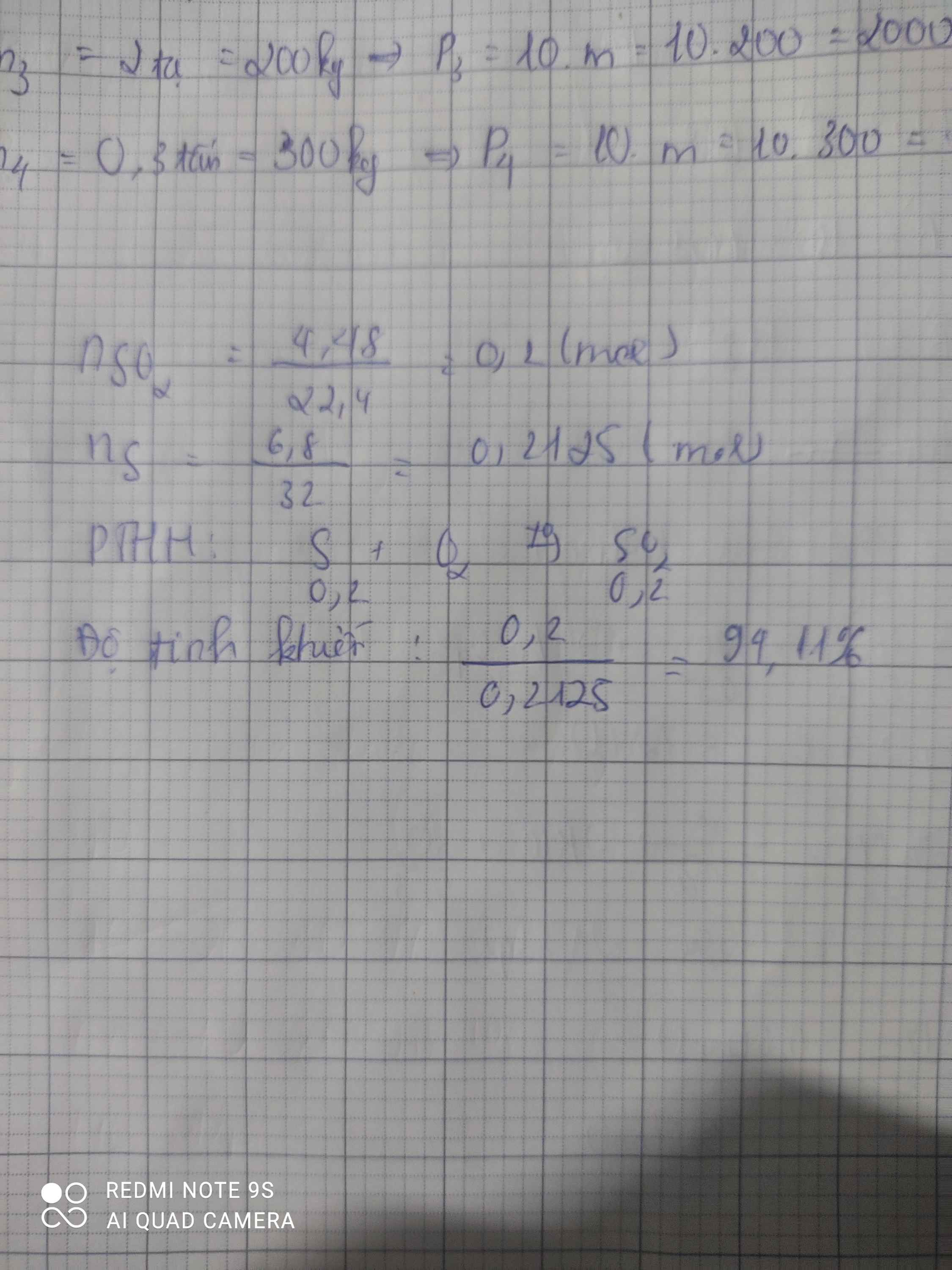Hàm lượng lưu huỳnh trong một mẫu dầu hỏa được xác định bằng cách đốt 4,476g mẫu trong lò. Sản phẩm đốt được đem dẫn vào dung dịch H2O2 3%. Khí SO2 cho PỨ: SO2 + H2O2 -> H2SO4. Người ta thêm vào phản ứng 25 ml dd NaOH 0,00923 M. Lượng NaOH dư đã PỨ hết với 13,33 ml dd HCl 0,01007 M. Tính % Lưu huỳnh trong mẫu.

Những câu hỏi liên quan
Để xác định nồng độ dung dịch H2O2 , người ta hòa tan 0,5 gam nước oxi già vào nước, thêm H2SO4 tạo môi trường axit. Chuẩn độ dung dịch thu được cần vừa đủ 10 ml dung dịch KMnO4 0,1M . Xác định hàm lượng H2O2 trong nước oxi già. A. 9% B. 17% C. 12% D. 21%
Đọc tiếp
Để xác định nồng độ dung dịch H2O2 , người ta hòa tan 0,5 gam nước oxi già vào nước, thêm H2SO4 tạo môi trường axit. Chuẩn độ dung dịch thu được cần vừa đủ 10 ml dung dịch KMnO4 0,1M . Xác định hàm lượng H2O2 trong nước oxi già.
A. 9%
B. 17%
C. 12%
D. 21%
đốt cháy 6,8g 1 mẫu lưu huỳnh không tinh khiết trong khí O2 dư người ta thu được 4,48l khí SO2 ở đktc.Hãy xác định độ tinh khiết của mẫu s
\(n_{SO_2}=\dfrac{4.48}{22,4}=0,2\left(mol\right)\)
PTHH : S + O2 ---to---> SO2
0,2 0,2
\(m_S=0,2.32=6,4\left(g\right)\)
Độ tinh khiết của lưu huỳnh là
\(\dfrac{6,4}{6,8}.100\%=94,11\%\)
Đúng 1
Bình luận (0)
S+O2-to>SO2
0,2----------0,2
n SO2=\(\dfrac{4,48}{22,4}\)=0,2 mol
=>m S=0,2.32=6,4g
=>độ tinh khiết là \(\dfrac{6,4}{6,8}\).100=94,11%
Đúng 1
Bình luận (0)
Cho các từ : vật lý, hóa học. hãy điền các từ trên vào chỗ trống sao cho hợp lý nhất:Hàm lượng cho phép của lưu huỳnh trong nhiên liệu là 0,3% theo khối lượng. Để xác định hàm lượng lưu huỳnh trong một loại nhiên liệu, người ta lấy nhiên liệu đem nghiền nhỏ gọi là hiện tượng ….., rồi đem đốt cháy hoàn toàn thu được hỗn hợp khí gồm cacbon đioxit, lưu huỳnh đioxit. Sau đó dẫn khí vào dụng dịch nước vôi trong thu được kết tủa trắng gọi là hiện tượng …..
Đọc tiếp
Cho các từ : vật lý, hóa học. hãy điền các từ trên vào chỗ trống sao cho hợp lý nhất:
Hàm lượng cho phép của lưu huỳnh trong nhiên liệu là 0,3% theo khối lượng. Để xác định hàm lượng lưu huỳnh trong một loại nhiên liệu, người ta lấy nhiên liệu đem nghiền nhỏ gọi là hiện tượng ….., rồi đem đốt cháy hoàn toàn thu được hỗn hợp khí gồm cacbon đioxit, lưu huỳnh đioxit. Sau đó dẫn khí vào dụng dịch nước vôi trong thu được kết tủa trắng gọi là hiện tượng …..
Đáp án
Hàm lượng cho phép của lưu huỳnh trong nhiên liệu là 0,3% theo khối lượng. Để xác minh hàm lượng lưu huỳnh trong một loại nhiên liệu, người ta lấy nhiên liệu đem nghiền nhỉ gọi là hiện tượng vật lý, rồi đem đốt cháy hoàn toàn thu được hỗn hợp khí gồm cacbon dioxit, lưu huỳnh dioxit. Sau đó, dẫn khí vào dung dịch nước vôi trong thấy tạo kết tủa trắng gọi là hiện tượng hóa học
Đúng 0
Bình luận (0)
Đốt cháy một lượng lưu huỳnh trong oxi thu được khí sunfuro (SO2). Dẫn khí này vào nước thu được axit sunfuro (H2SO3)
a) Viết phương trình phản ứng
b) Tính khối lượng lưu huỳnh đốt cháy biết VSO2 thu được 1,12 lít (đktc)
c) Tính khối lượng axit tương ứng
PTHH : \(S+O_2\left(t^o\right)->SO_2\) (1)
\(SO_2+H_2O->H_2SO_3\) (2)
\(n_{SO_2}=\dfrac{V_{đktc}}{22,4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
Từ (1) -> \(n_S=n_{SO_2}=0,05\left(mol\right)\)
-> \(m_S=n.M=1,6\left(g\right)\)
Từ (2) -> \(n_{H_2SO_3}=n_{SO_2}=0,05\left(mol\right)\)
-> \(m_{H_2SO_3}=n.M=0,05.\left(2+32+16.3\right)=4,1\left(g\right)\)
Đúng 2
Bình luận (0)
Câu 11. Cho 11,2 g CaO tác dụng với dung dịch có chứa 39,2 g H2SO4. Tính khối lượng các chất còn lại trong phản ứng hóa học trên (không tính khối lượng nước)Câu 12. Đốt cháy 6,4 g lưu huỳnh bằng 11,2 lít khí O2 (đktc) thu được sản phẩm là SO2. Tính thể tích của các khí thu được sau phản ứng hóa học trên ở đktcCâu 13. Đốt cháy 4,8 g cacbon bằng 6,72 lít khí oxi thu được sản phẩm sau phản ứng là CO2. Tìm khối lượng chất còn dư và thể tích khí CO2 thu đượcCâu 14. Cho 20,8 g BaCl2 tác dụng với dung...
Đọc tiếp
Câu 11. Cho 11,2 g CaO tác dụng với dung dịch có chứa 39,2 g H2SO4. Tính khối lượng các chất còn lại trong phản ứng hóa học trên (không tính khối lượng nước)
Câu 12. Đốt cháy 6,4 g lưu huỳnh bằng 11,2 lít khí O2 (đktc) thu được sản phẩm là SO2. Tính thể tích của các khí thu được sau phản ứng hóa học trên ở đktc
Câu 13. Đốt cháy 4,8 g cacbon bằng 6,72 lít khí oxi thu được sản phẩm sau phản ứng là CO2. Tìm khối lượng chất còn dư và thể tích khí CO2 thu được
Câu 14. Cho 20,8 g BaCl2 tác dụng với dung dịch chứa 9,8 g H2SO4. Tính khối lượng các chất thu được sau phản ứng.
Câu 15. Cho 20 g CuO tác dụng với dung dịch chứa 18,25 g HCl. Tính khối lượng các chất thu được sau phản ứng.
Câu 11:
\(n_{CaO}=\dfrac{11,2}{56}=0,2\left(mol\right);n_{H_2SO_4}=\dfrac{39,2}{98}=0,4\left(mol\right)\)
PTHH: \(CaO+H_2SO_4\rightarrow CaSO_4+H_2O\)
Ban đầu: 0,2 0,4 0,2
Sau pư: 0 0,2 0,2
`=>`\(\left\{{}\begin{matrix}m_{H_2SO_4}=0,2.98=19,6\left(g\right)\\m_{CaSO_4}=0,2.136=27,2\left(g\right)\end{matrix}\right.\)
Câu 12:
\(n_S=\dfrac{6,4}{32}=0,2\left(mol\right);n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: \(S+O_2\xrightarrow[]{t^o}SO_2\)
Ban đầu: 0,2 0,5
Sau pư: 0 0,3 0,2
`=>`\(\left\{{}\begin{matrix}V_{O_2}=0,3.22,4=6,72\left(l\right)\\V_{SO_2}=0,2.22,4=4,48\left(l\right)\end{matrix}\right.\)
Câu 13:
\(n_C=\dfrac{4,8}{12}=0,4\left(mol\right);n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: \(C+O_2\xrightarrow[]{t^o}CO_2\)
Ban đầu: 0,4 0,3
Sau pư: 0,1 0 0,3
`=>`\(\left\{{}\begin{matrix}m_{C\left(d\text{ư}\right)}=0,1.12=1,2\left(g\right)\\V_{CO_2}=0,3.22,4=6,72\left(l\right)\end{matrix}\right.\)
Câu 14:
\(n_{BaCl_2}=\dfrac{20,8}{208}=0,1\left(mol\right);n_{H_2SO_4}=\dfrac{9,8}{98}=0,1\left(mol\right)\)
PTHH: \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
Ban đầu: 0,1 0,1
Sau pư: 0 0 0,1 0,2
`=>`\(\left\{{}\begin{matrix}m_{BaSO_4}=0,1.233=23,3\left(g\right)\\m_{HCl}=0,2.36,5=7,3\left(g\right)\end{matrix}\right.\)
Câu 15:
\(n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right);n_{HCl}=\dfrac{18,25}{36,5}=0,5\left(mol\right)\)
PTHH: \(CuO+2HCl\rightarrow CuCl_2+H_2O\)
Ban đầu: 0,25 0,5
Sau pư: 0 0 0,25
`=>`\(m_{CuCl_2}=0,25.135=33,75\left(g\right)\)
Đúng 2
Bình luận (0)
Để xác định hàm lượng phần trăm cacbon trong một mẫu gang trắng, người ta đốt mẫu gang trong oxi dư. Sau đó, xác định lượng khí
C
O
2
tạo thành bằng cách dẫn khí qua nước vôi trong dư ; lọc lấy kết tủa, rửa sạch, sấy khô rồi đem cân. Với một mẫu gang khối lượng là 5,00 g và khối lượng kết tủa thu được là 1,00 g thì hàm lượng (%) cacbon trong mẫu gang là bao nhiêu ?
Đọc tiếp
Để xác định hàm lượng phần trăm cacbon trong một mẫu gang trắng, người ta đốt mẫu gang trong oxi dư. Sau đó, xác định lượng khí C O 2 tạo thành bằng cách dẫn khí qua nước vôi trong dư ; lọc lấy kết tủa, rửa sạch, sấy khô rồi đem cân. Với một mẫu gang khối lượng là 5,00 g và khối lượng kết tủa thu được là 1,00 g thì hàm lượng (%) cacbon trong mẫu gang là bao nhiêu ?
Khi đốt mẫu gang trong oxi, cacbon cháy tạo thành C O 2 . Dẫn C O 2 qua nước vôi trong dư, toàn bộ lượng C O 2 chuyển thành kết tủa C a C O 3 .
C + O 2 → t ° C O 2 (1)
C O 2 + C a ( O H ) 2 → C a C O 3 ↑ + H 2 O (2)
Theo các phản ứng (1) và (2): n c = n C O 2 = n C a C O 3 = 0,01 (mol)
Khối lượng cacbon: m C = 0,01.12 = 0,12 (g)
Hàm lượng (%) cacbon trong mẫu gang:
%C = 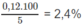
Đúng 0
Bình luận (0)
đốt cháy 6,8g một mẫu lưu huỳnh không tinh khiết trong khí õi dư người ta thu được 4,48l khí SO2 (dktc). hãy tính độ tinh khiết của mẫu lưu huỳnh trên
nS =nSO2=0,2 mol
mS= 6,4 gam
độ tinh khiết = 6,4/6,8=94,12%
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 99,2 gam một mẫu thép (chỉ gồm Fe và C) trong dung dịch H2SO4 đặc nóng, thu được 65,52 lít hỗn hợp khí (SO2 là sản phẩm khử duy nhất của S+6, ở đktc). Hàm lượng C trong mẫu thép trên là A. 1,93% B. 1,45% C. 1,69% D. 1,21%
Đọc tiếp
Hòa tan hoàn toàn 99,2 gam một mẫu thép (chỉ gồm Fe và C) trong dung dịch H2SO4 đặc nóng, thu được 65,52 lít hỗn hợp khí (SO2 là sản phẩm khử duy nhất của S+6, ở đktc). Hàm lượng C trong mẫu thép trên là
A. 1,93%
B. 1,45%
C. 1,69%
D. 1,21%
Đáp án D
Gọi n(Fe) = a và n(C) = b → 56a + 12b = 99,2
BT e: 3a + 4b =2n(SO2) → n(SO2) = 1,5a + 2b
→ n(hh khí) = 1,5a + 2b + b = 1,5a + 3b = 2,925
→ a = 1,75 và b = 0,1 → % = 0,1. 12. 100% : 99,2 = 1,21%
Đúng 0
Bình luận (0)
Hòa tan hoàn toàn 99,2 gam một mẫu thép (chỉ gồm Fe và C) trong dung dịch H2SO4 đặc nóng, thu được 65,52 lít hỗn hợp khí (SO2 là sản phẩm khử duy nhất của S+6, ở đktc). Hàm lượng C trong mẫu thép trên là A. 1,93% B. 1,45% C. 1,69% D. 1,21%
Đọc tiếp
Hòa tan hoàn toàn 99,2 gam một mẫu thép (chỉ gồm Fe và C) trong dung dịch H2SO4 đặc nóng, thu được 65,52 lít hỗn hợp khí (SO2 là sản phẩm khử duy nhất của S+6, ở đktc). Hàm lượng C trong mẫu thép trên là
A. 1,93%
B. 1,45%
C. 1,69%
D. 1,21%
Đáp án D
Gọi n(Fe) = a và n(C) = b → 56a + 12b = 99,2
BT e: 3a + 4b =2n(SO2) → n(SO2) = 1,5a + 2b
→ n(hh khí) = 1,5a + 2b + b = 1,5a + 3b = 2,925
→ a = 1,75 và b = 0,1 → % = 0,1. 12. 100% : 99,2 = 1,21%
Đúng 0
Bình luận (0)